|
示意图

论文首页
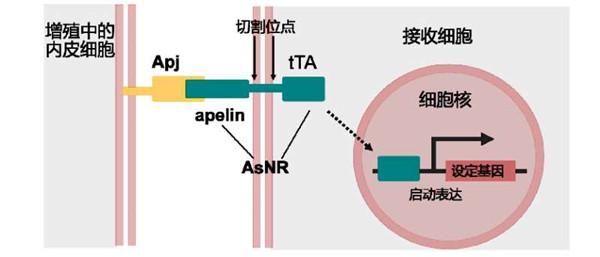
华山医院神经外科、复旦大学脑科学研究院朱剑虹教授研究团队最近在合成细胞生物学前沿领域取得重要进展,利用嵌合蛋白修饰工程细胞的关键受体,从而改变细胞的识别信号以及细胞应答。这种工程受体蛋白可以修饰多种类型的细胞,包括CD4+/CD8+ T细胞、神经干细胞、星形胶质细胞等。这些被人工修饰的工程化细胞被赋予了新的能力,能特异性识别新生的血管。根据不同临床研究需求定制不同的细胞感应或应答途径,既可以使工程细胞自主感应想要检测的疾病或损伤信号,也能够精确地进行治疗或修复,这为细胞治疗开辟了新的途径。5月2日,该项研究成果以“应用Apelin合成Notch受体识别血管新生和治疗实体肿瘤”(Using Apelin-based synthetic Notch receptors to detect angiogenesis and treat solid tumors)在线发表于《自然通讯》(Nature Communications)杂志上。该论文的共同第一作者王智富、王帆和钟俊杰为朱剑虹教授(通讯作者)的博士研究生。 在成体内,绝大部分血管处于静息状态,然而,一旦出现肿瘤、中风等病理变化,体内稳态被破坏,会导致血管内皮细胞重新进入增殖状态。有效地识别新生血管,可以实现对病灶区域的精准靶向投送。朱剑虹研究团队根据新生血管内皮的特异性受体/配体(Apj/apelin),通过改造synNotch受体的结构,设计研发出一种新型synNotch受体蛋白Apelin synthetic Notch receptors(AsNR),通过调节膜内段结构,提高了其识别的特异性,实现了对新生血管的特异性靶向。通过工程细胞在病灶区释放相应的信号因子,杀伤肿瘤细胞,同时可以激活T细胞的免疫应答,成功在体内抑制肿瘤的生长,为细胞治疗提供了一种新策略。 该项研究得到国家重点研发计划干细胞重点专项和国家自然科学基金的资助。 全文链接:https://www.nature.com/articles/s41467-020-15729-4
|







